如何在放疗期间将硼保留在细胞内
关于癌症生物学的日益增长的知识促进了涉及选择性靶向和杀死癌细胞的许多治疗策略的发展。一种这样的治疗选择是硼中子捕获疗法(BNCT),这是一种放射疗法,涉及将硼转移到癌细胞中,然后将其暴露于中子颗粒,使其发生核裂变,从而杀死癌细胞。如果我们可以确保硼仅存在于癌细胞中,那么我们可以特异性地仅破坏癌细胞,而不会损害人体的正常细胞。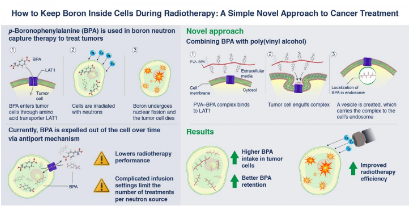
科学家首先发现了使用对-硼烷苯丙氨酸(BPA)诱导这种“选择性摄取”的方法。BPA是具有苯丙氨酸结构的含硼化合物。区别癌细胞与正常细胞的因素之一是被称为“ LAT1氨基酸转运蛋白”的特殊结构过多,该结构识别并允许苯丙氨酸转运进入细胞。因此,当BPA存在于癌细胞外部时,细胞表面的这些转运蛋白使其进入癌细胞,从而使BNCT成功。BPA一直被认为是BNCT最好的药物。
但是,BPA有一个缺点。一旦癌细胞中的BPA水平升高,就会通过“反转运”机制将其排出,这使BNCT在某些情况下有效具有挑战性。因此,要求患者接受30-60分钟的BPA连续输注,以维持细胞内所需的量以使反应成功。这也使门为人为错误打开,例如在处理过程中可能使针头脱落。
为了克服这些缺点,东京工业大学,京都大学和西山信弘教授领导的iCONM的科学家决定探索将硼保留在癌细胞中更长时间的其他方法。Nishiyama教授说:“我们假设,调节细胞内BPA的存在将确保它们不会通过反端口机制被送回。”
为了检查这一点,他们将称为聚乙烯醇(PVA)和BPA的化合物混合在一起,形成了PVA-BPA复合物,并观察了该化合物在癌细胞中的内在化。他们发现添加PVA不会影响BPA的苯丙氨酸结构,从而使LAT1转运蛋白能够识别PVA-BPA复合物。但是,由于这种复合物太大而无法通过转运蛋白,因此LAT1转运蛋白将复合物吞入称为内体的细胞器中,然后将其转运到细胞中。由于BPA现在安全地位于内体中,因此癌细胞无法通过反转运机制将其立即推出。这确保了硼在细胞中保留的时间足够长,可以有效杀死癌细胞。此方法也在动物模型中进行了测试,
因此,添加PVA提供了一种极其简单的解决方案,可增强BPA的治疗潜力。Nishiyama教授指出:“这项技术不费吹灰之力,并提供了一种新的给药方式,着重于药物的代谢消除过程。我们将与STELLA PHARMA CORPORATION合作推进PVA-BPA复合物的临床试验研究。谁进行了BPA临床试验。”
