RNA调节对于胚胎干细胞分化至关重要
胚胎干细胞(ESC)具有自我更新的双重能力和分化的潜能,两者都需要严格的调节控制。在ESC分化过程中,各种细胞会发展为特殊的细胞类型,例如皮肤细胞,神经细胞,肌肉细胞等。虽然我们对ES细胞调控的理解已被转录和表观遗传模型所主导,但转录后调控的作用是通过核RNA衰变的探索仍很少。
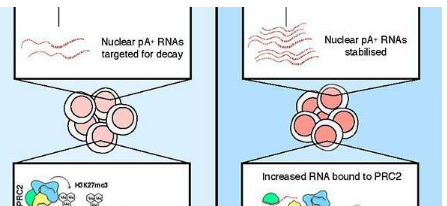
现在,丹麦的一个研究小组已经确定了由PolyA-tail eXosome Targeting'(PAXT)连接调控的过量核RNA水平与由Polycomb Repressive Complex 2(PRC2)进行转录控制之间的破坏性关系。研究人员提出,过量的RNA会通过隔离DNA来阻碍PRC2的功能。他们的结果突出了平衡核RNA水平的重要性,并证明了大分子RNA调节染色质相关蛋白的能力。
以前,Torben Heick Jensen实验室已经确定PAXT连接并将其表征为衔接子复合体,该复合体将聚腺苷酸化(pA +)RNA靶向核RNA外泌体以进行衰变。耗尽包括锌指蛋白ZFC3H1在内的PAXT成分后,细胞就会稳定并积累pA + RNA。这为研究细胞核中过量pA + RNA的一般作用提供了一种方法。
有趣的是,在小鼠ESC中使用CRISPR / Cas9去除PAXT成分ZFC3H1随后破坏了它们的分化能力。高通量测序分析表明,Zfc3h1-/-敲除(KO)ES 细胞显示出分化相关RNA的表达增加,这些表达通常被PRC2复合物沉默。进一步研究表明,由于Zfc3h1-/-KO导致RNA过量结合,PRC2复合物的功能和稳定性受到损害。总之,这突出了通过活跃的RNA衰变保持稳定的核转录组的重要性,以防止由于RNA积累而产生脱靶效应。
这些发现是奥尔胡斯大学分子生物学和遗传学系的Torben Heick Jensen实验室与哥本哈根大学生物技术研究与创新中心的Kristian Helin实验室合作项目的结果,该实验室由Novo Nordisk Foundation Center资助。干细胞生物学(DanStem)研究RNA调节在ES细胞生物学中的作用。这项研究主要由奥尔胡斯大学的Will Garland进行。
