新研究解释了艾滋病毒如何避免ZAP感染
人类已经进化出了动态防御机制,可以抵抗试图感染我们身体的病毒,这些蛋白质专门用于识别,捕获和破坏病毒试图潜入我们细胞的遗传物质。
一项计划于11月11日当周在《美国国家科学院院刊》上发表的新研究现在不仅揭示了这些蛋白质中的一种如何锁存在外来入侵者上,而且还揭示了某些病毒(包括人类免疫缺陷病毒)如何逃避捕获。
在某些情况下,揭示使该蛋白成为有效抗病毒剂的精确机制是迈向攻击设法躲避它的病毒的更好方法的关键的第一步。
这种被称为ZAP(锌指抗病毒蛋白的简称)的蛋白质是由细胞制造的,用以限制病毒复制和传播感染。当细胞检测到病毒时,ZAP基因就会打开并产生更多的蛋白质。然后,ZAP从细胞的天然RNA中分离出病毒的遗传物质RNA,并以病毒RNA为目标进行破坏。
来自密歇根大学生命科学研究所和洛克菲勒大学的一组研究人员希望确定ZAP如何识别该病毒的基因组,以及某些病毒如何避免它。
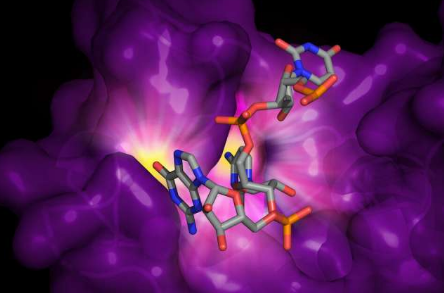
洛克菲勒(Rockefeller)先前的一项研究表明,ZAP仅抓住相邻核苷酸的一个特定序列(DNA和RNA的组成部分):胞嘧啶,然后是鸟嘌呤或CG二核苷酸。人的RNA几乎没有CG二核苷酸,而HIV RNA可以模仿这种特征。
UM LSI的研究人员,该研究的主要作者之一詹妮弗·梅格(Jennifer Meagher)说:“这项研究的主要动机是'艾滋病毒如何避免这种抗病毒蛋白?”。“而且由于我们是结构生物学家,我们想确定ZAP如何'看见'CG二核苷酸,以及在结构上如何结合RNA。”
Meagher和她在UM的Meagher和她的同事使用经过基因改造的病毒RNA,包括额外的CG序列,确定了与RNA结合的ZAP蛋白的结构,从而揭示了使蛋白具有如此高选择性的机制。
研究人员发现ZAP仅在蛋白质上四个“锌指”之一上与病毒RNA结合,他们认为这是潜在的结合位点。他们进一步证明,即使对该键合位点进行微小的改变(仅改变单个原子),也会影响ZAP的键合能力。
洛克菲勒公司的研究人员在细胞中工作时,改变ZAP的成分时发现了相似的结果。他们创建了ZAP的突变型,它们在感染了正常HIV或富含CG序列的病毒的细胞中表达。
突变的ZAP蛋白不太能够识别细胞中病毒RNA的富含CG的区域。它们还显示出与不富含CG二核苷酸的RNA区域的结合增加,表明这种改变会损害ZAP区分病毒RNA与人RNA的能力。
霍华德·休斯医学研究所研究员,洛克菲勒逆转录病毒实验室负责人Paul Bieniasz表示:“自然选择似乎已经形成了ZAP蛋白结构,从而优化了基于CG二核苷酸含量的非自身与自身RNA的区分。” 。“但是,成功的病毒通常在分子军备竞赛中领先一步。”
密西根州立大学医学院的LSI研究教授兼生物化学教授珍妮特·史密斯(Janet Smith)说:“这是有关细胞最终如何降解病毒 RNA 的复杂故事的关键的第一步。” “现在我们知道该步骤是如何执行的,以及为什么它对缺乏此CG序列的HIV和其他病毒无效。”
该研究是通过HIV RNA研究中心完成的,并得到了美国国立卫生研究院,霍华德·休斯医学研究所,密歇根州经济发展公司和密歇根州技术三走廊的支持。X射线晶体学数据是在阿贡国家实验室的美国能源部先进光子源处收集的。
在PNAS论文题为“在配合物与RNA锌指抗病毒蛋白的结构揭示机制富含CG病毒序列的选择性靶向”。
